Uno studio conclusosi in Europa ha dimostrato che le vaccinazioni COVID provocano danni cerebrali a lungo termine. Questo studio pre-print pubblicato sul server bioRxiv ha rilevato che le proteine spike introdotte dagli mRNA infestano i tessuti cerebrali dei vaccinati.
I farmaci mangiavita producono sia effetti immediati che a lungo termine; con ulteriori dosi, proteine spike e altri elementi si diffondono nel corpo, tra cui i tessuti cerebrali, provocando problemi di salute cronici e definitivi. Telomeri e DNA sono così esposti a sempre maggiore corruzione, con conseguente invecchiamento precoce e morte.
I FARMACI MANGIAVITA NON HANNO FRETTA: PRIMA DI UCCIDERTI DIVORANO QUEL PO’ DI CERVELLO CHE TI È RIMASTO
La malattia da coronavirus 2019 (COVID-19), causata dalla sindrome respiratoria acuta grave coronavirus di tipo 2 (SARS-CoV-2), è stata associata principalmente a una serie di sintomi neurologici, tra cui annebbiamento cerebrale e perdita di tessuto cerebrale, sollevando preoccupazioni circa il impatto acuto e potenziale cronico del virus sul sistema nervoso centrale. In questo studio, abbiamo utilizzato modelli murini e tessuti post mortem umani per studiare la presenza e la distribuzione della proteina spike SARS-CoV-2 nell’asse cranio-meningi-cervello. I nostri risultati hanno rivelato l’accumulo della proteina spike nel midollo cranico, nelle meningi cerebrali e nel parenchima cerebrale. L’iniezione della sola proteina spike ha causato la morte cellulare nel cervello, evidenziando un effetto diretto sul tessuto cerebrale. Inoltre, abbiamo osservato la presenza della proteina spike nel cranio dei deceduti molto tempo dopo la loro infezione da COVID-19, suggerendo che la persistenza del picco può contribuire a sintomi neurologici a lungo termine. La proteina spike era associata a percorsi correlati ai neutrofili e alla disregolazione delle proteine coinvolte nel PI3K-AKT, nonché nel percorso del complemento e della coagulazione. Nel complesso, i nostri risultati suggeriscono che il traffico di proteine spike di SARS-CoV-2 dai confini del SNC al parenchima cerebrale e i percorsi regolati in modo differenziato identificati possono presentare approfondimenti sui meccanismi alla base delle conseguenze immediate e a lungo termine della SARS-CoV-2 e presentare opportunità diagnostiche e terapeutiche . La proteina spike era associata a percorsi correlati ai neutrofili e alla disregolazione delle proteine coinvolte nel PI3K-AKT, nonché nel percorso del complemento e della coagulazione. Nel complesso, i nostri risultati suggeriscono che il traffico di proteine spike di SARS-CoV-2 dai confini del SNC al parenchima cerebrale e i percorsi regolati in modo differenziato identificati possono presentare approfondimenti sui meccanismi alla base delle conseguenze immediate e a lungo termine della SARS-CoV-2 e presentare opportunità diagnostiche e terapeutiche . La proteina spike era associata a percorsi correlati ai neutrofili e alla disregolazione delle proteine coinvolte nel PI3K-AKT, nonché nel percorso del complemento e della coagulazione. Nel complesso, i nostri risultati suggeriscono che il traffico di proteine spike di SARS-CoV-2 dai confini del SNC al parenchima cerebrale e i percorsi regolati in modo differenziato identificati possono presentare approfondimenti sui meccanismi alla base delle conseguenze immediate e a lungo termine della SARS-CoV-2 e presentare opportunità diagnostiche e terapeutiche .
Breve riassunto L’accumulo della proteina spike SARS-CoV-2 nell’asse cranio-meningi-cervello presenta potenziali meccanismi molecolari e bersagli terapeutici per complicanze neurologiche nei pazienti con COVID-19 lungo .
INTRODUZIONE
L’infezione da SARS-CoV-2 è associata a numerose complicanze neurologiche e neuropsichiatriche 1 – 3 , tra cui anosmia, disgeusia, affaticamento, mialgia, depressione, mal di testa, encefalopatia e meningite e aumenta anche sostanzialmente il rischio di ictus ischemico 4 , 5 . Anche i pazienti con casi lievi di COVID-19 spesso soffrono di effetti SARS-CoV-2 a lungo termine nel cervello, tra cui appannamento, riduzione dello spessore della materia grigia e dimensioni del cervello 6-8 . Diversi studi hanno studiato il coinvolgimento del sistema nervoso centrale (SNC) nei sintomi correlati a COVID-19 e, sebbene SARS-CoV-2 sia stato rilevato nel tessuto cerebrale in alcuni campioni e studi 3 , 9 –12 , altri studi non sono riusciti a rilevare il virus 12-16 . Vari problemi tecnici come la contaminazione dal sangue nei metodi basati sulla PCR, l’errata identificazione dei capillari come parenchima nell’immunoistochimica, errori di colorazione utilizzando anticorpi inappropriati 17 o differenze nelle popolazioni di pazienti potrebbero spiegare questa discrepanza. Tuttavia, anche senza RNA virale rilevabile nel parenchima cerebrale, potrebbero essere rilevati segni di diffusa attivazione immunitaria 18. La mancanza di prove della presenza virale e in particolare della replicazione virale nel cervello ha portato all’ipotesi che le proteine del virus liberate che circolano nel flusso sanguigno possano promuovere una risposta infiammatoria indipendente dall’infezione virale diretta degli organi colpiti, compreso il cervello 19 , 20 . In particolare, la proteina spike altamente immunogenica , utilizzata anche nei vaccini COVID-19 21-23 , potrebbe essere un candidato per innescare effetti indipendenti dall’infezione.
È stato dimostrato che la proteina spike influenza la funzione endoteliale in vitro 24-26 e in vivo 27 , 28 e induce risposte infiammatorie mediate da TLR2 in vitro dopo l’iniezione intraperitoneale nei topi 29 , ma non è stato possibile osservare se tali risposte possano essere osservate anche nei pazienti indagato a fondo. Tuttavia, la lunga persistenza della proteina spike è stata dimostrata nelle cellule immunitarie del paziente (almeno 15 mesi) 30 e nel plasma sanguigno del paziente (almeno 12 mesi in un preprint) 31 . È stato dimostrato che la proteina spike libera radiomarcata attraversa la barriera emato-encefalica dei topi ed entra nel parenchima cerebrale 32. Tuttavia, a causa della risoluzione limitata dei metodi impiegati, le vie esatte di ingresso della proteina spike nel cervello, i loro bersagli e i cambiamenti molecolari associati all’accumulo di proteina spike nel tessuto cerebrale rimangono in gran parte poco chiari 33 , 34 .
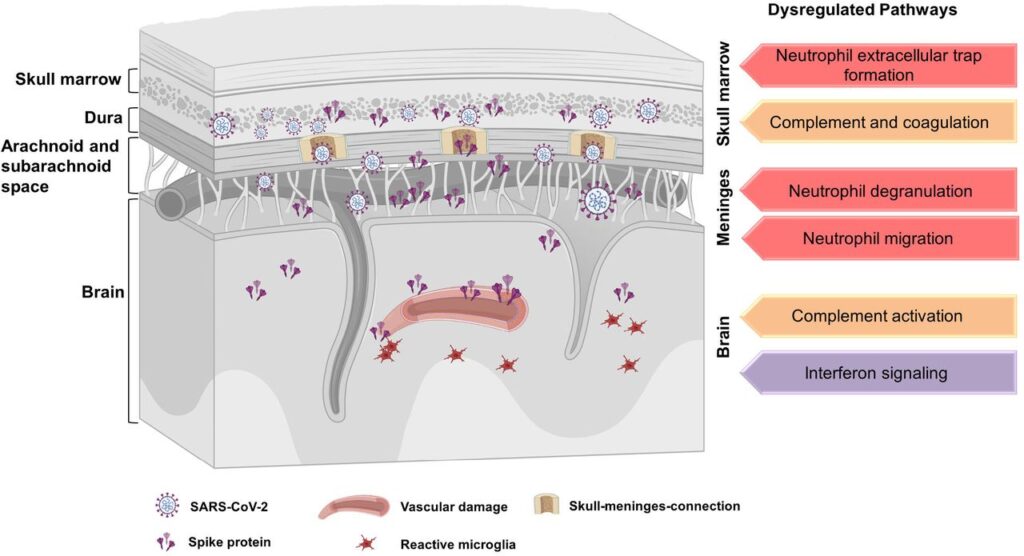
Qui, abbiamo utilizzato la compensazione ottica del tessuto per identificare tutti i tessuti che hanno accumulato la proteina della punta SARS-CoV-2 nei topi e abbiamo studiato la distribuzione della proteina della punta nei campioni post mortem dei pazienti COVID-19. Caratterizziamo anche le conseguenze dell’espressione proteica delle infezioni da SARS-CoV-2 in diversi tessuti del cranio da campioni umani post mortem con proteomica basata sulla spettrometria di massa. Abbiamo trovato un accumulo di proteina spike nelle nicchie del midollo cranico, recentemente scoperta connessione cranio-meningi (SMC) 35 – 40, meningi e parenchima cerebrale sia nei topi che nei campioni umani. I dati di proteomica umana hanno mostrato una disregolazione delle cascate del complemento e della coagulazione, percorsi correlati ai neutrofili e una sovraregolazione delle proteine pro-infiammatorie. L’iniezione di proteine spike nelle nicchie del midollo cranico direttamente nei topi sani ha innescato cambiamenti proteomi e morte cellulare nel parenchima cerebrale. Sorprendentemente, abbiamo identificato la proteina spike persistente nei campioni di cranio di un sottogruppo di individui che si sono ripresi da COVID-19 e sono morti per cause non correlate a COVID. Pertanto, l’accumulo di SARS-CoV-2 e della proteina spike ai confini del SNC può contribuire ai cambiamenti nel cervello, suggerendo un possibile meccanismo per gli effetti neurologici dell’infezione da SARS-CoV-2.
RISULTATI
Distribuzione in tutto il corpo della proteina spike S1 in un modello murino
Per identificare tutti i potenziali tessuti presi di mira da SARS-CoV-2, abbiamo mappato la distribuzione della proteina spike S1 con etichetta fluorescente in topi trasparenti intatti. Sebbene non sia una misurazione diretta del tropismo virale, studi recenti hanno dimostrato l’utilità della proteina spike ricombinante come proxy per studiare il targeting e la patologia della SARS-CoV-2 nei topi 32 , 27 .
La proteina spike WT ha una bassa affinità di legame per l’enzima di conversione dell’angiotensina 2 (ACE2) del topo 41 , 42 . Non è stato possibile utilizzare la linea murina transgenica K18-hACE2, che arborisce la forma umana di ACE2 (hACE2) guidata dal promotore della citocheratina 18 che porta a una sovraespressione ectopica di hACE2 43che pregiudicherebbe l’analisi della biodistribuzione. Pertanto, abbiamo coniugato Alexa-647 per aumentare la proteina S1 (N501Y) che trasporta la mutazione, che consente il legame con l’isoforma ACE2 del topo. Come controllo, abbiamo anche coniugato Alexa-647 al picco WT e all’emoagglutinina (HA) del virus dell’influenza per confronto. Dopo 30 minuti dall’iniezione endovenosa, i topi sono stati sottoposti a perfusione transcardiaca e tutto il loro corpo è stato sottoposto a trasparenza ottica e ripreso mediante microscopia a foglio luminoso 44 . Abbiamo rilevato il legame del picco S1 nella maggior parte degli organi, inclusi cuore, polmone, fegato, rene, intestino, timo, milza e pancreas, in contrasto con il picco WT S1 e HA più esclusivo del fegato e del polmone (Fig. 1A ) . All’interno di ciascun organo, il picco S1 si è accumulato molto vicino ai vasi sanguigni (Fig 1B , punte di freccia contro frecce) nel fegato, nei reni e nei polmoni ( Video 1 ). La maggior parte del segnale del picco S1 nell’addome era situato nel letto capillare e molto probabilmente dalle cellule di Kupffer del fegato, dai follicoli della milza, dai glomeruli e dagli alveoli. La proteina Spike S1 è stata trovata anche nel parenchima del testicolo e dell’ovaio ( Fig. S1A , Video 2 ). La distribuzione multiorgano del legame della punta S1 è coerente con il noto pattern di espressione di ACE2, ampiamente espresso in vari organi e che funge da recettore di ingresso cellulare per SARS-CoV-2 45 , 46 .
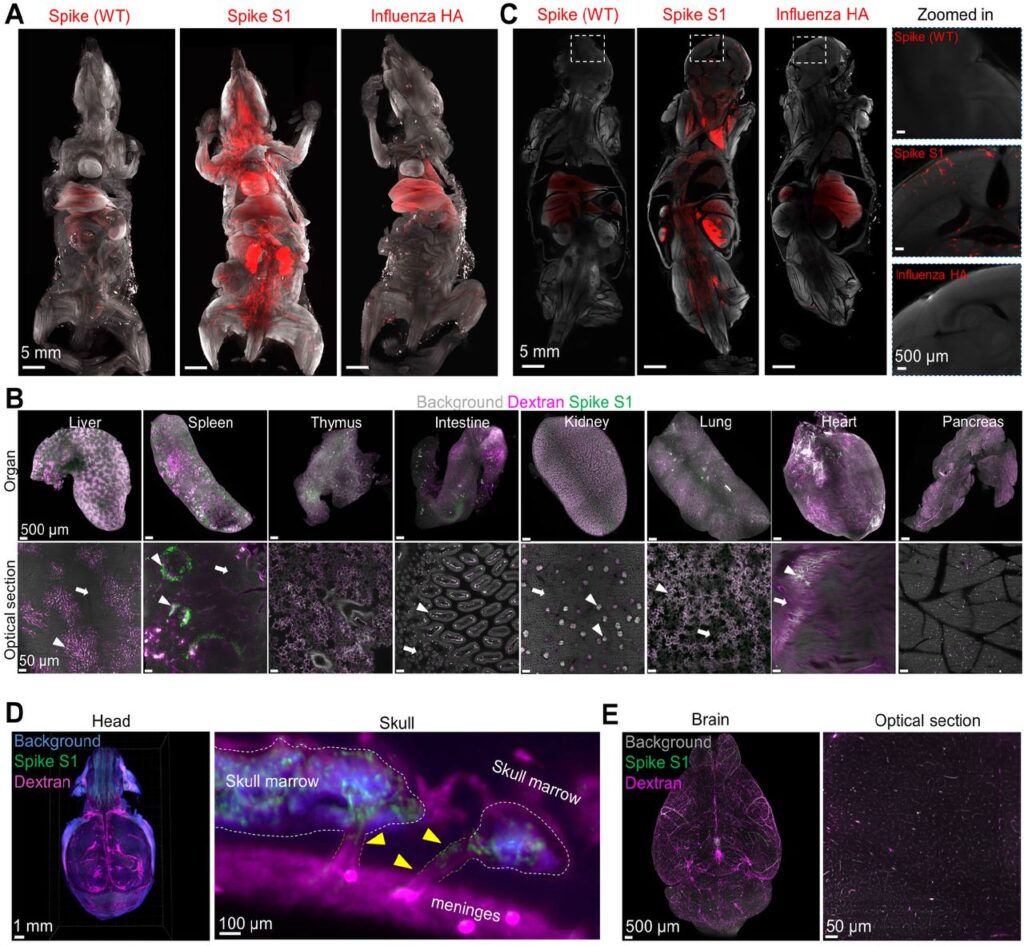
La proteina Spike mostra una capacità di legame multiorgano
Ricostruzioni 3D dell’intero corpo del topo dopo la proteina spike (WT), il picco S1 (N501Y) e l’iniezione di HA, ripreso con microscopia a foglio leggero. (B) Ricostruzione 3D dei principali organi interni e vista in sezione ottica rappresentativa ad alta risoluzione con proteina spike S1 (N501Y) e vascolarizzazione marcata con destrano. Le punte e le frecce delle frecce indicano rispettivamente le regioni con e senza la proteina spike S1. (C) Sezione ottica delle immagini di tutto il corpo dopo l’iniezione di proteina spike (WT), picco S1 (N501Y) e HA. L’area della scatola bianca è stata ingrandita per controllare il cervello. (D) Visualizzazione della proteina spike S1 (N501Y) nella testa del topo intatta e immagini sagittali rappresentative del midollo osseo del cranio, delle SMC e delle meningi. Le punte delle frecce indicano la proteina spike S1 nelle SMC. (E) Immagini rappresentative della proteina spike S1 (N501Y) nel cervello.
Inoltre, il picco S1 è stato rilevato anche nella corteccia prefrontale del cervello ( Fig. 1C , Video 3 ). Esaminando ulteriormente le teste dei topi, abbiamo trovato un sostanziale accumulo di spike S1 nelle nicchie del midollo cranico ( Fig. 1D , Video 4 ). In particolare, abbiamo rilevato la proteina spike nei canali che collegano il midollo cranico alle meningi ( Fig. 1D ), suggerendo che le SMC potrebbero svolgere un ruolo nella distribuzione della proteina S1 attraverso il cranio oltre ad altre potenziali vie, come il trasporto di cellule fagocitiche o stravaso diretto dai vasi sanguigni. Allo stesso modo, la proteina spike S1 si è accumulata nel midollo da altre ossa come le ossa lunghe, la tibia e il femore, indicando che raggiunge le nicchie del midollo osseo ( Fig. S1B). Nel sistema nervoso centrale, abbiamo trovato la proteina spike nelle diverse regioni del cervello e del midollo spinale ( Video 5 ). Co-colorando con il destrano per la visualizzazione dei vasi, abbiamo scoperto che la proteina spike S1 era principalmente localizzata nei vasi sanguigni del cervello ( Fig. 1E )
Infezione da SARS-CoV-2 nel cranio umano, nelle meningi e nel cervello
Il midollo osseo del cranio è stato caratterizzato come serbatoi di cellule mieloidi per le meningi e il parenchima del SNC attraverso i canali tra il midollo cranico e le meningi 35-37 , 47 . La nicchia linfopoietica è identificata anche nelle meningi di confine del SNC 38-40 , suggerendo il coinvolgimento del cranio e delle meningi nelle malattie neurologiche . Uno studio ha riportato la transizione dei batteri dal liquido cerebrospinale attraverso i canali nelle cavità del midollo cranico 48 . Pertanto, abbiamo ipotizzato che le connessioni tra midollo cranico e meningi 49-54potrebbe contribuire all’ingresso del virus SARS-CoV-2 nel cervello. Per prima cosa abbiamo studiato la distribuzione del SARS-CoV-2 nei tessuti cranici post mortem di pazienti deceduti per infezione da COVID-19 (n = 17 diversi casi di COVID-19, n = 10 avevano anche meningi attaccate, Fig. 2A , Tabella 1 ). Abbiamo utilizzato il protocollo SHANEL di compensazione ottica sviluppato per il tessuto umano di grandi dimensioni 55 e l’imaging tridimensionale (3D) per analizzare il profilo istopatologico dei campioni di cranio umano con la dura madre allegata. Abbiamo identificato la proteina spike virale nelle nicchie del midollo cranico, nelle SMC e nelle meningi di pazienti con infezione da SARS-CoV-2 ( Fig. 2B , Video 6 e 7 ). Non è stata rilevata alcuna etichettatura della proteina spike nei campioni di individui di controllo ( Fig. S2A). Abbiamo trovato la proteina spike nel collagene IV e nei vasi sanguigni CD31-positivi, ma anche il 44,8% al di fuori dei vasi sanguigni nelle nicchie del midollo cranico ( Fig. 2C e 2D ), suggerendo che la proteina spike sia trapelata nel midollo cranico (Video 8 e 9). Inoltre, con l’imaging confocale, abbiamo localizzato la proteina spike nello spazio perinucleare delle cellule meningee e nelle vicinanze dei neuroni NeuN-positivi nella corteccia cerebrale ( Fig. 2E ). Abbiamo anche analizzato i polmoni di questi pazienti, dove abbiamo identificato la co-espressione di ACE2 e proteina spike ( Fig. S2B ). Nelle meningi dei pazienti infetti, abbiamo riscontrato una concomitante diminuzione di ACE2 ( Fig. S2C ) coerente con la downregulation di ACE2 e la disfunzione endoteliale riportate nei pazienti COVID-1928 .
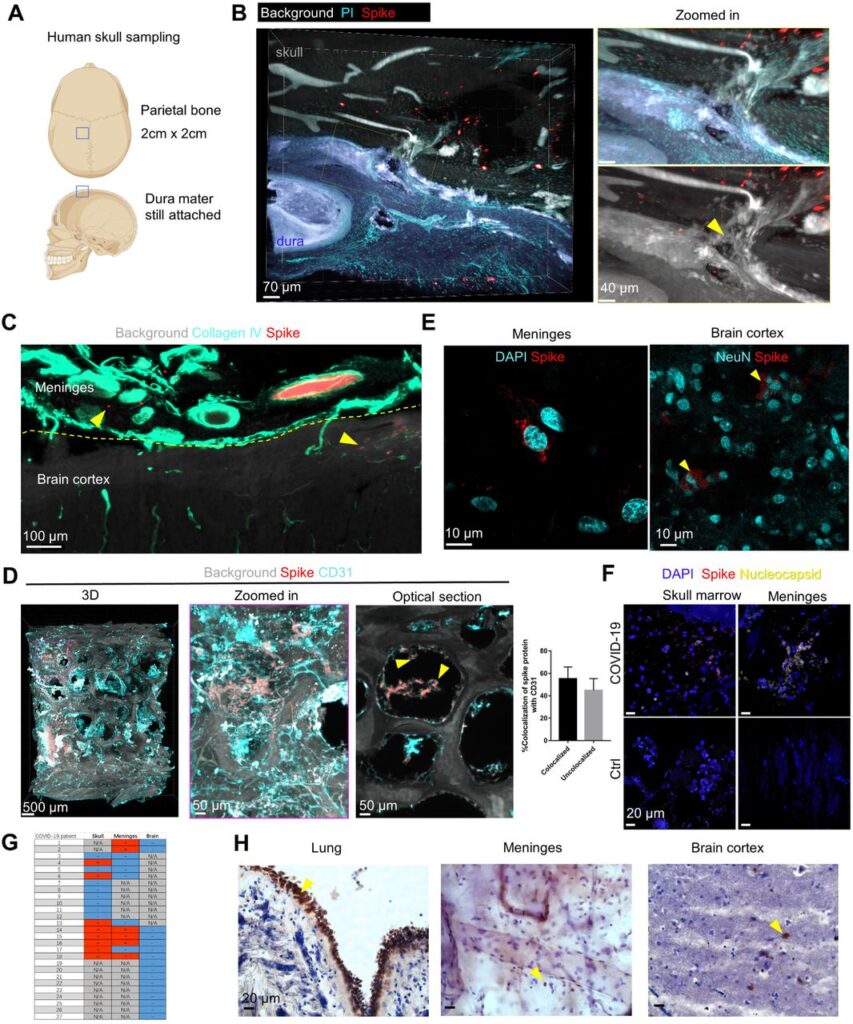
Infezione da SARS-CoV-2 nel cranio umano, nelle meningi e nel cervello
(A) Illustrazione per il campionamento del cranio umano con meningi. (B) Immagini rappresentative dell’anticorpo proteico della punta e dell’etichettatura PI nel cranio del paziente COVID-19 con meningi. La dura madre (blu) viene segmentata manualmente in base all’autofluorescenza e importata per la ricostruzione 3D in Imaris. La freccia gialla indica un segnale positivo nell’SMC. (C) Immagine rappresentativa della proteina spike e della colorazione dell’anticorpo IV del collagene nel cervello del paziente COVID-19 con meningi. (D) Immagini rappresentative dell’anticorpo proteico della punta e dell’etichettatura dell’anticorpo CD31 nel cranio del paziente COVID-19 con meningi. Le punte di freccia indicano la proteina spike nella nicchia del midollo cranico. Quantificazione della colocalizzazione della proteina spike con segnale CD31 in 6 sezioni ottiche. I dati sono media ± SEM. (E) Immagini confocali rappresentative dell’etichettatura dell’anticorpo della proteina spike nelle meningi del paziente COVID-19 e nella corteccia cerebrale. (F) Immagini confocali rappresentative della proteina spike e della proteina nucleocapside nel midollo e nelle meningi del cranio umano. (G) Risultati RT-PCR di campioni di cranio, meningi e cervello di pazienti COVID-19. N/A, non disponibile. (H) Immunoistochimica della proteina della punta nel polmone, nelle meningi e nella corteccia cerebrale del paziente COVID-19. Proteina della punta mostrata in marrone, nucleo cellulare in blu. Le frecce gialle indicano regioni positive. Proteina della punta mostrata in marrone, nucleo cellulare in blu. Le frecce gialle indicano regioni positive. Proteina della punta mostrata in marrone, nucleo cellulare in blu. Le frecce gialle indicano regioni positive.
L’RNA SARS-CoV-2 è stato rilevato in 8/16 campioni di cranio e 6/12 campioni di meningi di pazienti COVID-19 mediante RT-PCR, insieme alla proteina nucleocapside ( Fig. 2F ). Tutti i campioni di corteccia prefrontale cerebrale che abbiamo ispezionato erano negativi alla PCR ( Fig. 2G ) e inoltre non abbiamo rilevato la proteina nucleocapside ( Fig. S2D ). La presenza della proteina spike in assenza di carica virale (PCR negativa) nel cervello e nelle meningi degli stessi pazienti ( Fig. 2H ) suggerirebbe o un meccanismo specifico di captazione nel cervello o un’emivita più lunga della proteina spike rispetto a Particelle virali SARS-CoV-2.
Profilo proteomico del midollo cranico, delle meningi e dei campioni cerebrali dei pazienti COVID-19
Per esplorare le conseguenze dell’infezione da SARS-CoV-2 e dell’accumulo di proteine spike ai confini del SNC, abbiamo eseguito un’analisi proteomica quantitativa senza etichetta basata sulla spettrometria di massa di tessuti umani corrispondenti alla regione da pazienti e controlli COVID-19 (non-COVID- 19) ( Tabella 1 ).
Nei campioni di midollo cranico, sono state identificate un totale di 6504 proteine m tra i campioni di pazienti COVID-19 (n = 10) e controlli (n = 10) (sono stati analizzati solo campioni con cranio e meningi degli stessi pazienti, Fig . .S3A ). Mentre abbiamo osservato un’elevata concordanza all’interno dei gruppi (coefficienti di correlazione di Pearson: da 0,67 a 0,87 nei controlli e da 0,68 a 0,93 nei campioni COVID-19) ( Fig. S3B ), la correlazione tra COVID-19 e campioni di controllo era relativamente bassa o moderata (Pearson coefficienti di correlazione: da 0,55 a 0,84) suggerendo un’influenza sostanziale e riproducibile dell’infezione virale sui profili di espressione proteica nel midollo cranico. Il grafico dell’analisi dei componenti principali (PCA) ha mostrato una chiara segregazione dei campioni di midollo cranico da COVID-19 e gruppo di controllo (Figura 3A ). Abbiamo identificato 655 proteine espresse in modo differenziato nel midollo cranico COVID-19, con 496 sovraregolate e 159 sottoregolate ( Fig. S3C ). Abbiamo trovato un’espressione ridotta dei fattori di ingresso associati alle cellule ospiti SARS-CoV-2 neuropilina 1 (NRP1) 56 . Tuttavia, altri fattori di ingresso del coronavirus come la neuropilina 2 (NRP2), la dipeptidil peptidasi 4 (DPP4, nota anche come CD26) 57 , 58 , la basignina (BSG, nota anche come CD147) e l’alanil aminopeptidasi (ANPEP, nota anche come CD13) 57 e la catepsina B (CTSB) 59 è rimasta invariata.
















